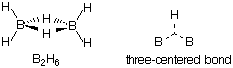
<2電子で1結合とは限らない>
ホウ素は原子価電子を3個もち、3本の共有結合を形成することができる。しかし、そうしてできた分子の中ではホウ素原子は6電子しかもてないため、安定な閉殻構造をとることができない。三フッ化ホウ素(BF3)などホウ素のハロゲン化物が強いルイス酸性をもち、すなわち他の分子の非共有電子対と結合しやすい性質をもつのはこのためである。
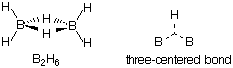
ところで、ボランと総称される水素化ホウ素類は興味深い構造をもっていることが知られている。最も単純なボランはBH3であるが、この分子は遊離では存在せず、二量体のジボラン(B2H6)となっている。ジボランは二つのBH3がお互いの水素を橋架けにして結合していた構造をとっている。このB-H-B間の結合は2電子で3個の原子が結合しており、3中心2電子結合とよばれる特殊な結合である。この電子対を共有電子対と考えれば、ホウ素原子は8電子構造となり、安定化できるという寸法である。
このように電子不足原子であるホウ素の化学は大変に興味深い。