化学よもやま話
最終更新日:2020.9.26
肩の凝らない化学閑話のページをスタートさせました。雑多な話題、感想などなど、有機化学にとどまらない話もここで扱います。
どこかのコラムに「かんわじかん」(緩和時間: relaxation time) というのがあって、洒落てるなあと思ってましたが、こちらはその域には全然達していないので、まあ暇つぶしのお役にしか立てません(^^;。
・ヘリウムと炭素のJカップリング
・希液体元素コペルニシウムの謎
・ビスマス神話の崩壊
・「塩」は「i」なもの「アジ」なもの
・塩化ナトリウム vs. ナトリウム化塩素
・ヘキサフェニルエタン!?
・窒素は奇奇怪怪
・亜アンチモン酸
・科学の美しさ
 ヘリウムと炭素のJカップリング
ヘリウムと炭素のJカップリング
2020.9.26追加
NMRは化合物の構造情報を得る分析手段としてはとても重要な手法です。NMR分析によって得られる情報はいろいろありますが、最も重要でよく利用されるのは化学シフトと結合定数でしょう。このうち結合定数とは、簡単にいうと観測する原子核と結合している別の原子核との相互作用(Jカップリング)によって生じるピークの分裂幅を指します。この値の大きさによって二つの原子核の相互関係がわかるわけです。1H-NMRでの隣接水素数や介在する結合本数の情報とか13C-NMRでの観測炭素に結合している水素数の情報などは有機化合物の構造解析になくてはならないものです。よくわからないという人はぜひ「ビギナーズ有機構造解析」で勉強してください(笑)。
このほど、ヘリウムの同位体3Heと13Cの間のJカップリングが初めて観測されました。ヘリウムの主安定同位体は4Heですが、100万分の1の存在比で3Heが存在します。4Heは陽子数中性子数とも偶数なので磁気スピンをもたずNMRでは観測できませんが、中性子数が奇数の3HeはNMRシグナルを与えます(NMRで観測できない12Cと観測できる13Cの関係と同じです)。しかも3Heは磁気回転比が水素の約75%と大きいので観測しやすい核といえます。なのですが、いかんせんヘリウムは貴ガス元素ですから化学結合というものをつくりません。近年極限状況下でNa2Heをつくったという報告がありますが、それくらいです。それでは3Heと13Cの間のJカップリング観測というのはどういうことでしょう。
実は、本来原子核同士の結合を介した相互作用であるJカップリングは、空間的に制限された系では電子雲を介した非結合相互作用でも起こることがすでに知られています。そこで今回の主役は原子内包フラーレンのひとつ3He@C60(フラーレンのカゴの中にヘリウム原子を1個閉じ込めた分子)です。内部が空のフラーレンC60ではすべての炭素原子は等価なので13C-NMRでは単一線が1本だけ観測されます。ところが3He@C60では、ヘリウム原子がフラーレン殻の内部の狭い空間に押し込められているために、非結合相互作用が生じてフラーレン炭素の13Cシグナルが3HeとのJカップリングによって二重線に分裂していることが観測されました。測定条件は、25 mM 3He@C60(43% filling factor)の重水素化オルトジクロルベンゼン溶液、340 K、16.45 T(13C周波数175 MHz)で、J (3He, 13C)値は77.5 mHzです。
しかしよくぞ観測したものです。天然存在比の極めて小さい3Heを選択的に内包したフラーレンをある程度の量合成し(これにはおもしろ化合物第37話「カゴの鳥」で書いた分子手術を用います)、それを高分解能のNMR測定でわずか0.08 Hz という微細分裂を観測しなければならないのですから。こうなると、すでに合成されているH2@C60やHF@C60なんかはどうなんだろうという気になりますね。NMR的には3Heよりはずっと観測しやすいでしょうけど単一原子じゃないので対称性などが問題になりそうです。
著者は誰かとみてみると、あのMLEVシーケンスのM. Levittでした。さすがです。
G. R. Bacanu, J. Rantaharju, G. Hoffman, M. C. Walkey, S. Bloodworth, M. Concistre, R. J. Whitby, and M. H. Levitt, J. Am. Chem. Soc. doi.org/10.1021/jacs.0c08586.
 希液体元素コペルニシウムの謎
希液体元素コペルニシウムの謎
2019.10.11追加
わけのわからないタイトルですみません。希ガスならわかるけど希液体?と誰しも思うところでしょうが、noble gasが希ガスなのだからnoble liquidは希液体というよりないでしょう。一方のコペルニシウム(Cn)はれっきとした112番元素で、1996年に人工合成されて大天文学者コペルニクスにちなんで命名されたものです。このCn、周期表上は第7周期の12族元素で水銀(Hg)の一周期下に位置します。人工超重元素なので物性値を測定できるほどの量が存在しないのですが、その位置からHgに似た揮発性の液体金属と推定されていました。このほど理論計算による物性の推定が報告され、それによると相対論効果を考慮するとCnは融点10±11 ℃、沸点67±10 ℃の液体であり、凝集エネルギーの小ささ(-0.38 eV)やバンドギャップエネルギーの大きさ(6.4 eV)から揮発性で金属性を示さず、なんと18族希ガス元素の一員に近い性質をもつことが示されました。なので希液体元素というわけです。第7周期の18族元素(すなわちラドンの直下の位置)としては、最近113番元素ニホニウムと同時に命名が発表された118番オガネソン(Og)がありますが、Cnは計算上はこのOgよりも18族的性質が強いというから驚きです。
なぜそうなるのかという正確な説明は私の理解を超えますが、簡単に言うとCn原子の電子配置がその鍵になっています。原子の電子配置は大まかにいうと原子番号の増えるにつれて1s(He)→2s→2p(Ne)→3s→3p(Ar)→4s→3d[Zn]→4p(Kr)→5s→4d[Cd]→5p(Xe)→6s→4f→5d[Hg]→6p(Rn)→7s→5f→6d[Cn]→7p(Og)となっていて、最外殻のs, p軌道がすべて満たされているのが18族希ガス元素(丸カッコ)です。そして最外殻のs軌道のみが満たされてp軌道が空なのが12族元素(カギカッコ)です。18族元素はいわば電子がきっちり詰まった状態なので電子の授受が困難であり、すなわち化学的に不活性で安定な性質をもちます。12族元素はs軌道電子の放出が可能なので二価陽イオンになる性質をもち、実際に亜鉛やカドミウム、水銀はそうなります。しかしs軌道電子は球状分布をもっていて他の副殻(p, d, f...)より原子核に近い性質があります。原子核に近いと運動速度が大きくなるので相対論効果によって質量が増加します。相対論効果は原子番号の二乗で増加するので、Hgではこの寄与が効いてきて電子の放出が抑えられそれが融点降下をもたらしています。Cnではこの効果がさらに強いため凝集エネルギーの低下とバンドギャップエネルギーの増加によって低融点、金属性低下につながっているというわけです。
常温で液体の元素は珍しく、これまで知られているのは水銀と臭素のみです。もちろんこれは理論計算による予測に過ぎませんが、こんな周期表の下の方の重たいところにぽっかりと液体元素が沈んでいるなんて不思議ですね。
J. -M. Mewes, O. R. Smits, G. Kresse, and P. Schwerdtfeger, Angew. Chem. Int. Ed. 10.1002/anie.201906966.
 ビスマス神話の崩壊
ビスマス神話の崩壊
2003.12.29追加
地球上には何種類の元素が存在するかという問題はなかなかの難問です。きちんとした名前のついている元素は原子番号1番の水素から109番のマイトネリウムまで109個あるのは周知の通りですが、この中には人工的につくられた放射性元素が多数含まれていますから、そのすべてが存在するわけではありません。安定同位体が存在する元素で最も原子番号の大きいのは83番元素ビスマスで、それを超える元素はすべて放射性元素です。もっとも放射性元素でもウランやラジウムのように天然鉱物中に存在しているものもありますから、放射性の有無だけで存在するしないを云々するわけにはいきません。さらに、原子番号43番テクネチウムや61番プロメチウムのようにビスマスよりも軽くてもなぜか天然に存在しない元素もあります。というわけで私には冒頭の問題の答えはわからないのですが、非放射性安定元素はいくつあるかという問題なら83-2=81個と答えられます。
原子核が大きく重くなるにつれ、安定性が減少してついには自己崩壊するようになります。その限界にあるのが原子番号83質量数209のビスマスで、これが最も重い安定同位体ということになっています。ではなぜ209Biが最重安定同位体なのでしょうか。原子核にはマジックナンバーというのがあり、陽子数あるいは中性子数がその数に等しい原子核は安定になることが知られています。2, 8, 20, 28, 50, 82, 126というのがそれです。原子番号でいうとヘリウム、酸素、カルシウム、ニッケル、スズ、鉛の順で、いずれも天然存在度の高い安定そうな元素が並びます。原子番号82番の鉛には安定同位体が4種類ありますが、このうち最も存在度の高い質量数208のものは中性子数が126で、陽子、中性子ともにマジックナンバーをとる安定性の高い核です。天然に安定に存在していても不思議はありませんね。この208Pbより1個陽子が多いのが209Biということになります。陽子数が奇数になり安定性は低下しますが(窒素は奇奇怪怪参照)、中性子数は同じ126なので安定になっているのでしょう。
ところが、驚いたことにこの最重安定核と思われていた209Biがごくわずかながらα崩壊して205Tlへ変化している、という実験的証明が最近報告されました。209Biの半減期は1.9±0.2×1019年という途方もない時間だそうです。α粒子のようなエネルギーの低い粒子がこんなに低頻度でしか放射されないのを、バックグラウンドの影響を排除した有意な値として実験的に確認するのがどれほど大変なことかは想像に余りあります。実験の詳細は私の理解を超えていますが、0.02Kという超低温でシンチレーションボロメーターによる精密な変化を測定することによって検出しています。
奇数核であるビスマスは安定同位体が209Bi1種類しかありませんから、すなわち最重安定元素の座は鉛(208Pb)にうつるということになりますね。
P. de Marcillac, N. Coron, G. Dambier, J. Leblanc, and J. -P. Moalic, Nature, 422, 876 (2003).
 「塩」は「i」なもの「アジ」なもの
「塩」は「i」なもの「アジ」なもの
2001.2.5追加
アジ化ナトリウム(NaN3)といえば、彗星のように現れて一世を風靡した毒物です。類は友を呼ぶというか事件が事件を呼ぶというか、研究室での異物混入事件をいえば必ずというほど登場していました。もちろんアジ化ナトリウム自体はそれほど毒性が強いというわけでもなく、ごく普通の試薬です。生化学用には防腐剤として普通に用いられていますね。うちの研究室にも以前は当然のことながら試薬棚に無造作に置かれていました。それがいまや特別扱いとして厳重に施錠された棚に保管されることになってしまいました。まさに二階級特進というわけです。
さて、なんでこんなにアジ化ナトリウムばかりが愛用されたのかという考証はともかく、この化合物の名前はちょっと変わっています。塩化ナトリウム、臭化ナトリウムなどの二元素間塩類の命名は、陰イオン成分を「○化」とあらわします。本来は塩素化、臭素化となるところを、「素」を省略しているのでしょう。ちなみに水素化ナトリウムだけは水化ナトリウムとはいわないのは、水和物などと紛らわしいからかもしれません。
シアン化ナトリウム(こちらは猛毒ですね)というのもあって、これはハロゲンに準ずる陰性成分としてシアン化物(cyanide)イオンをもっています。アジ化物(azide)イオンは窒素だけからなるイオンですが、形式的にはこれに似ています。対応する酸をシアン化水素酸、アジ化水素酸というのも似ていますね(もちろん、窒化物(nitride)イオンをもつ窒化ナトリウム(Na3N)というのもありますが、これは別物です)。
では、なぜcyanideがシアン化物なのにazideはアズ化物じゃなくてアジ化物なんでしょう。たしかに、az-のような子音で終わる閉音節は日本語になじまないので、普通は母音をつけて開音節化するのはわかりますが、それならもともと窒素を意味するazo-という語(語源はギリシャ語のa(反する)+zoe(生命))がありますから、アゾ化物のほうがいいでしょう。外来語で語尾が開音節化される場合は、cup(カップ)、bat(バット)のようにu音やo音が付加される例が大半です。おそらくaz(i)という開音節化は、az-ideをazi-deというふうな音節区切りに引っ張られてのものではないかと推測されます。化合物名でこのような和訳例は私の知る限り他にありません(外来語では、stick(ステッキ)、deck(デッキ)などのi付加例はあることはありますが)。
まさに「塩」は「i」なもの「アジ」なものというわけです。
 塩化ナトリウム vs. ナトリウム化塩素
(@nifty FCHEMT【縁側】会議室 #876 より)
塩化ナトリウム vs. ナトリウム化塩素
(@nifty FCHEMT【縁側】会議室 #876 より)
2000.5.31追加
食塩(塩化ナトリウム)はナトリウムイオンと塩化物イオンからなるイオン性化合物であるなんていうのはいうまでもないですね。ところで、私の学生時代はCl-は塩素イオンと習いました。「硝酸銀溶液で塩素イオンを検出する」てなぐあいです。なんで塩素イオンが塩化物イオンなどというもってまわったいい方に変わったかというと、電子を受けとってできた陰イオンはchlorine→chlorideというように塩化物のイオンだからという考えでしょう。塩素を酸化してできるCl+イオンが存在することから、それとの区別をきちんとすることになったわけです。
今の学生は当然塩化物イオンと習ってきていますから、大学の講義でもちゃんとそういわなければならないのですが、つい習慣で塩素イオンといってしまい、いいなおすことがあったりします(^^;。一度講義の中でOH-イオンが出てきて水酸イオンといおうとして一瞬詰まったこともあります。そのときはとっさに塩化物→水酸化物と連想して水酸化物イオンなる語をひねり出してことなきを得たのですが、水酸イオンといういい方もなくなってしまったのかはいまだにわかりません。
希ガス原子の閉殻構造(オクテット構造)は非常に安定で、電子が軌道を満たしていない他の原子では、安定な閉殻構造になろうとするために、最外殻に7個電子をもつ塩素は1個電子を受け取って安定な塩化物イオン(Cl-)となり、逆に最外殻に余分な1個の電子をもつナトリウムは1個電子を放出して安定なナトリウムイオン(Na+)となる、というのは化学の基本ですし、有機化学の導入でも必ず教わります。しかし、Cl+やBr+などというハロゲンのカチオンがあることを知ってしまうと、こんなステレオタイプな説明ではうまくないかもしれません。幸い学生からそういう質問を受けたことはまだないですが、どうやったらわかりやすく説明できるか困りますね(ここを読んでいるあなた、質問しないでね(笑))。
ところで、ここまではまあ許せます。しかしなんとこんどはNa-イオンやK-イオンなるものがあるというではないですか。それぞれ、sodide ion、potasside ionだそうです。日本語ではナトリウム化物イオン、カリウム化物イオンといわねばなりません。s軌道に電子が2個はいって準安定状態になるのかなと想像しますが、しかしねえ。それも窒素を多数含むクリプタンド化合物中では室温で3ヶ月以上も変化しないほど安定な結晶をつくるのだそうです(*)。こういう事実を知ってしまうと、塩素とナトリウムからなるイオン性化合物はなんて設問に対して、塩化ナトリウムではなくナトリウム化塩素なんて答が出てきたらどう採点したものか悩みますね(^^;;。
以前、有機化学の試験問題にブロモベンゼンとカリウムアミドの反応を出したことがあります。ベンザイン経由でアニリンができるやつなんですが、その反応機構を書かせると、かなりの学生がカリウムアミドから無理やりNH2+を発生させて、おなじみの芳香族求電子置換反応を起こさせてました。試験の講評で私はカリウムアミドからNH2+なんかを発生させたら、残ったカリウムはどうなるのか、K-なんてイオンができるわけがあるか、常識で考えなさい!と悪態をついたものです。とても今となってはそういう説明はできなくなってしまったわけですね(笑)。
* J. Kim et al., J. Am. Chem. Soc., 1999, 121, 10666.
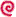 ヘキサフェニルエタン!?
ヘキサフェニルエタン!?
1999.10.5追加
講談社ブルーバックス「パソコンで見る動く分子事典」を共著で書いたのですが、さっそくp280に校正ミスが見つかりました。そのままでは申し訳ないので、ここに訂正とともに関連する話を少し書き足しておきます。
ベンゼン環がいっぱいある化合物の話で、オクタフェニルナフタレンとその類縁体の構造を説明した後に、ヘキサフェニルエタンがでてきたので、つい校正で見逃したのですね。自分で構造式を書くときはまちがいっこないので、そんな炭素の原子価が違うような図ができるはずがない、という思い込みもあって、見落としたものでしょう(と言い訳(^^;)。
つまり、
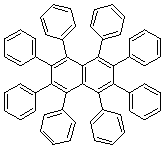
こういう化合物(この構造は正しい)に気を取られて...、
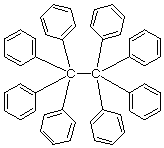
ついこんな誤構造(し、信じられない...)を見落とした。
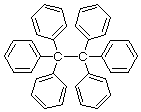
もちろん正しい構造はこう。
と思いきや、実はこれも間違い!?
ヘキサフェニルエタンはベンゼン環同士の立体的反発で中心のCC結合が切れやすく、容易にホモリシスを起こしてトリフェニルメチルラジカルになります。というより溶液中ではヘキサフェニルエタンとトリフェニルメチルラジカルの平衡状態にあります(ベンゼン中20℃では、ヘキサフェニルエタン:トリフェニルメチルラジカル(×2)=97:3)。このトリフェニルメチルラジカルが、溶液中に安定に存在することが1897年に初めて見出されたラジカル種ということで有名です。
しかし、実はトリフェニルメチルラジカルを生むもとのヘキサフェニルエタンと思われた分子はヘキサフェニルエタンではないことが知られています。
正しい構造は、
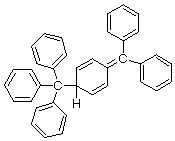
実はこうでした。
トリフェニルメチルラジカルの中心炭素同士は、立体障害で結合することができず、片側はベンゼン環のパラ位で結合を形成するのですね。
ブルーバックスのp280の図がカッコでくくられているのは、これは正しい構造ではない、という意味があったのです。それが「本当に」正しくない構造になってしまったのですから、まさに“校正おそるべし”です。
実際にはない仮想構造を載せたりしたものだから、たたられたのかもしれません(笑)。
 窒素は奇奇怪怪
(NIFTY SERVE FCHEMT【縁側】会議室 #738 より)
窒素は奇奇怪怪
(NIFTY SERVE FCHEMT【縁側】会議室 #738 より)
1999.4.22追加
新学期が始まって、また有機化学の講義がはじまりました。有機化学とは何かという説明をするときに、有機化合物の定義をしなければなりませんが、これがなかなかやっかいです。例の、「炭素の化合物ただし一部の簡単な化合物を除く」というやつですね。それはともかく、ではなんで炭素の化合物だけが特別扱いなのか、と話が進んで炭素の特殊性に行きつきます。その話はまあ耳にタコの人もいると思いますので、ここではちょっと違った観点からの特殊性の話です。
自然は偶数を好む、と言った人がいるかどうか知りませんが(^^;、事実はそうらしいです。たとえば、有機化合物は偶数炭素数の化合物の方が奇数炭素数化合物より多い、というのがバイルシュタインのデータベースからわかっていますし、ケンブリッジ構造データベースでも同じだそうです。まあこれはたぶん普通の脂肪酸が偶数炭素のものが圧倒的に多いことから推定されるように、C2ユニットが生合成の基本単位になっていることに由来するのでしょう。
では、原子核の場合はどうでしょう。宇宙における元素の存在度なんてデータがあって(どうやって調べるんでしょうね(^^;)、宇宙では軽い元素ほど多く、重い元素ほど少ないことが知られています。横軸に原子番号、縦軸に存在度をプロットする右下がりのグラフができあがります。ところがよくみるとこのグラフはなだらかな線ではなくて、ジグザグになってるんですね。つまり偶数原子番号元素の存在度は両隣の奇数番号元素のそれよりも常に高いのです。偶数原子番号すなわち陽子数が偶数の原子核の方が奇数のものよりも安定なことがわかります。
次に安定同位体表を見てみます。安定同位体の質量と天然存在比を原子番号順に並べたあれです。すぐに気づくのは、安定同位体数の多い元素と少ない元素が交互に並んでいることです。偶数原子番号元素はたいてい3種以上安定同位体が存在します。50番のスズにいたっては10種もあります。それに対し、奇数原子番号元素で安定同位体を3種以上もつものはただの一つもありません(カリウムは微妙ですが、一つは自然放射性核なので除いてもいいでしょう)。安定同位体が1種しかない元素は20個ありますが、ベリリウムを除いてすべて奇数元素です。
中性子数はと見てみると、各元素の最安定同位体はベリリウムと窒素と白金を除いてすべて中性子数が偶数です。で、ここにやっと窒素がでてきました(^^;。窒素の安定同位体は14Nと15Nがありますが、ご存じのように14Nの方が99.6%と圧倒的に多いです。この14N核は陽子数も中性子数も奇数です。こういう核を奇奇核といいますが、いかにも不安定そうですね。そうです、窒素は奇奇核を最安定同位体にもつ唯一の元素なんです。なぜ15Nの方が多くないのか不思議です。まさに窒素は奇奇怪怪ですね(笑)。
ちなみに、陽子数も中性子数もともに偶数の偶偶核は逆に安定な核でその数も多いですが、偶偶核は核スピン量子数が0であり、NMRで観測することはできません。12Cや16Oが見えるといいなと思いますが、残念ですね(^^;。
 亜アンチモン酸
(NIFTY SERVE FCHEMT【縁側】会議室 #729 より)
亜アンチモン酸
(NIFTY SERVE FCHEMT【縁側】会議室 #729 より)
1999.4.11追加
サラ金などの名前は「あ」ではじまるものが多いとか。これは電話帳で見たときに最初のほうに並ぶからだそうです。たしかに職業別(っていわないのかな今は)電話帳で引くときはなんとなく項目の最初のほうから見ていきますからね。では辞典で一番最初に出てくる化合物はなんでしょう。
岩波理化学辞典ではしばらく「亜アンチモン酸」でした。さすが語頭に「あ」が二つならんでいますね。私は変な子供でして、理化学辞典を初めて買ったのは小学生のときですが(第2版増補版)、書店の店頭で最初のページを開けてみると、この亜アンチモン酸が劈頭を飾っていました。亜硫酸、亜リン酸、亜硝酸なら知ってましたが、亜アンチモン酸にはぶっとびました。化学ってなんて奥が深いのだろう、まだまだ知らないことがいっぱいあるのだ、と子供心にわくわくしたものです。というわけで私にとってこの亜アンチモン酸はとても懐かしい化合物なのです。
しかし考えてみると「あ」で始まる元素ならすべて「亜アなんとか酸」になる権利(^^;;があるわけですね。アンチモンは二番目が「ん」だからどちらかというと分が悪いほうで、五十音順の元素表では、アインスタイニウム、亜鉛、アクチニウム、アスタチン、アメリシウム、アルゴン、アルミニウム、アンチモンの順ですから8番目に過ぎません。ただ、亜〜酸となるためには、酸性か両性酸化物で二通り以上の酸化度をとれなければいけませんから、なんでもというわけにはいきません。
上記の8個の元素では、アルゴンは論外(^^;として、亜鉛とアルミニウムは酸化度が一種類しかありません。亜亜鉛酸はちょっと魅力的ですけど。でもzincous acidならどん尻かも(笑)。また、アインスタイニウム、アクチニウム、アメリシウムはいずれも放射性元素ですし、塩基性が強そうです。となると望みの綱はこれも放射性元素ですがアスタチンですか。アスタチンはハロゲン元素でヨウ素の一回り下に位置しますから、ひょっとしたら亜アスタチン酸があるかもしれません。でも亜塩素酸、亜臭素酸はあるのに、亜ヨウ素酸は項目としてないから無理なのかも。
実は、理化学辞典も最新の第5版ではこの「亜アンチモン酸」の項目はなくなって、酸化アンチモンの項で触れられるだけになってしまいました。なんかさびしいです。子供の頃手に取ったのがこの第5版だったら、私は別の道に進んでいたかもしれないなと思ったりします。
 科学の美しさ
(北大農学部札幌同窓会誌平成9年第13号寄稿文より)
科学の美しさ
(北大農学部札幌同窓会誌平成9年第13号寄稿文より)
前期の講義が終わった。まだ夏休み明けに試験があるが、まずはやれやれである。2年生向け一般教育科目の化学IIを担当して今年で2年目。最初にひきうけたときに、いったいどうやってどんな内容で講義をしたらいいか考えた。旧農芸化学科時代に学部3年生へ有機化学を講義した経験はあるが、一般教育科目となると、農学部生向けとはいえ、生物資源科学から農業経済学科まで、およそ有機化学とは縁遠い道へ進む学生も混じっているわけである。聞いてみると、高校で化学を習ってこなかった学生すらいるという。これは大変なことになった。むろん化学が好きで化学系の学科に進んだという学生もいるだろうし、いったいどこを向いてどんな講義をしようか。
こういうときにはまずは低いところに基準をおいて始めるのが親切というものかもしれないが、それでは半年だとメタンの構造くらいで終わってしまいそうだ。そこで考えた。どうせ半年では膨大な有機化学の内容をすべて教えることなどできっこないから的を絞って、トピックス方式でやろう。ただし内容に関して妥協はしない。有機化学の華ともいうべき(と私は信じている)ベンゼンの共鳴構造や求核、求電子置換反応機構などはしっかり教える。化学が苦手な学生には難しいかもしれないが、その中で一人でも二人でも、その美しさ、明快さに気がついてくれればそれでよかろう。自己満足かもしれないがそう考えた。
化学、いや科学のすばらしさは、単純な理論で複雑な事象が解き明かされる点にあるといっても過言でないと思う。それをとにかく実感してほしい。有機化学の知識なんて実はどうでもいいので、有機化学という言葉で、科学とはどういうものかを伝えることだ。個々の理論や物質の性質、反応などは巷にあふれているどんな有機化学の教科書にも載っているし、いまさら私が拙い講義で付け加えることはない。それよりも、いかに複雑な事象が単純な理論の応用で解き明かされていくか、その美しさの一端でも感じ取ってほしいと思う。おそらく有機化学に限らず、これは科学一般に通じることだと思う。表面的な事実を丸暗記するだけでは、興味もわかないだろうし、それが昨今の若者の科学離れにつながっているとしたら、それは不幸なことである。その奥にある原理を知ることによって、混沌としていたものが霧が晴れるように明快に浮かび上がるのを見る快感。科学のそんなすばらしさをぜひ感じ取ってほしい。
実は、こんなことを考えたのは、私自身が学生時代に化学を教えていただいた先生方から、とりもなおさずこの科学の美しさに目を見開かされた経験があるからである。私が教養部理類2年生のとき、この化学IIを教わったのが、理学部の黒沢悦郎先生だった。当時は高校の化学ではほとんど有機化学は出てこなかったので、事実上、この講義が私と有機化学の出会いといえる。半年間の講義の内容の大半は忘れてしまったが、ひとつだけ鮮やかな印象としてはっきり覚えているのが、芳香族求電子置換反応の置換基効果、いわゆる置換ベンゼンのオルト・パラ、メタ配向性の講義である。その明快な講義に触れて私の有機化学観は一変した。置換基の種類によって生成物が変わってくる一見不思議な現象が、有機電子論の考え方によってきわめて明快に説明されていくさまに私はただ呆然と見とれていた。すばらしい。科学とはなんて美しいのだろう、心底そう思った。この時の感動がおそらくその後の自分の進路を決める大きな要因になったことは間違いないだろう。色々紆余曲折はあったものの、いまこうして同じ化学IIの講義を若い学生相手にする立場になっているわけだから。
ところで、黒沢先生の思い出を書いたからには、もうお一人の先生に触れねばならない。それは学部3年のときに有機化合物研究法を教わったやはり当時理学部の故西田進也先生である。西田先生はその当時たしか阪大から北大に移られてまもない頃で、関西風の口調で機器分析の講義をされていた。先生はひずみのかかった小員環の反応がご専門で、講義のなかにも随所に面白い構造や性質の化合物の話が散りばめられて大変魅力的だった。ブルバレンは47回の連続的なコープ転位を経て隣接する2炭素が入れ替わり、その繰り返しによって高温ではすべての炭素、水素が等価になってしまう。う〜む、なんて美しい。そして何より面白い。将来こんな研究がしたい、単純な私はそう思った。それはともかく、因果はめぐるというわけではないが、現在のカリキュラムでは機器分析化学という講義があり、その半期2単位の半分を私は今担当しているわけだから、若き日の影響というものは恐ろしいものだと思う。そしてなにより、私の有機化学の講義におもしろ化合物の話が時折登場するのは、この西田先生の影響なのである。
自分がこれほどの影響を講義を通じて学生に与えられるとは思わないが、自分が感動した思いを少しでも次の世代に伝えたい。半年の講義を終えて、もっとああすればよかったこう言えばよかったという悔恨ばかりを胸に、また自分自身を叱咤勉励しつつ新たな開講の日を待っている。
![]() 塩化ナトリウム vs. ナトリウム化塩素
(@nifty FCHEMT【縁側】会議室 #876 より)
塩化ナトリウム vs. ナトリウム化塩素
(@nifty FCHEMT【縁側】会議室 #876 より)




![]() 窒素は奇奇怪怪
(NIFTY SERVE FCHEMT【縁側】会議室 #738 より)
窒素は奇奇怪怪
(NIFTY SERVE FCHEMT【縁側】会議室 #738 より)
![]() 亜アンチモン酸
(NIFTY SERVE FCHEMT【縁側】会議室 #729 より)
亜アンチモン酸
(NIFTY SERVE FCHEMT【縁側】会議室 #729 より)
![]() 科学の美しさ
(北大農学部札幌同窓会誌平成9年第13号寄稿文より)
科学の美しさ
(北大農学部札幌同窓会誌平成9年第13号寄稿文より)