 ベンゼンの仲間たち −sp2炭素の世界−
ベンゼンの仲間たち −sp2炭素の世界−
<ベンゼンの描き方いろいろ>
ダイヤモンドが正四面体をつみあげた立体的な脂肪族化合物の究極の形だとすれば、その対極に位置するのは、平面的な安定分子ベンゼンだ。では、その仲間たちの世界をのぞいてみよう。その前にちょっとベンゼン自身の説明をしておこう。ベンゼンは六角形に二重結合がひとつおきにはいった形をしている。このときに二重結合の書き方に図のaとbの2通りある(この違いは全体を回転させたのではなく、炭素の位置は固定して二重結合の位置を入れ替えたものと理解してほしい)。

実はこの両者は同じ意味なのである。そもそも二重結合の2本目の結合(π結合)はsp2炭素がふたつ並んでいるときにπ電子が並行に並ぶことによってできる結合である。ベンゼンの場合すべての炭素はsp2炭素なので、隣同士の炭素を二重結合で順につないでいくというよりも、最初からすべてのπ電子が環状につながっていると考えたほうが自然である。ベンゼンの構造を描くときにcのように六角形に○を描くやり方があるが、これは実は非常に構造をよく表しているのである。つまり実際のベンゼンは二重結合の位置が固定しているのではなく、すべての炭素炭素結合がいってみれば1.5重結合とでもいう状態dにあるのだ。それを六角形に二重結合3個で描くのは昔からの便宜的な記法という意味しかない(ただ反応の説明などで電子の動きを考えるときにはこの方が便利な意味もあるので、反応機構の説明にはこちらが使われることが多い)。だから図のa、b、c、dは区別する意味はない。ここでは二重結合の位置を明示する必要のないときにはcの描き方を使うことにする。
<ベンゼン環をならべていく>
まずベンゼン環を一辺を共有するように次々につなげていった分子がある。2個つながった分子が防虫剤でおなじみのナフタレンだ。3個になるとつながり方によってアントラセンとフェナントレンの2種類の異性体がある。4個になるとさらに異性体が増えるが、代表的なのは、直線状につながったナフタセンとジグザグにつながったクリセンだ。このようにベンゼン環をどんどん一方向につなぐやり方には直線状とジグザグがあり、直線状のをアセン系、ジグザグが混じっているのをフェン系という。六角形にひとつおきに二重結合が3個はいったベンゼン共役系をすべての環に書くことのできるフェン系の方が、それができないアセン系よりも安定である。ナフタセンでは二重結合をどのように入れていっても、eのようなジメチレンシクロヘキサジエン構造ができてしまう。クリセンではこれができないことを確かめてほしい。

次にタイルを敷くように平面に敷き詰めてみよう。ベンゼン環4個を敷き詰めたのがピレンで、コールタール中の強力発ガン物質として有名なベンゾピレンはその仲間である。さらに大きなものには5環性のペリレン、7環性のコロネンなどがあり、いずれも安定な分子である。コロネンはベンゼン環6個を一辺がベンゼン2個からなる六角形につなげた形に相当する。この場合、中心の空間もちょうど六角形になるので、自然とここもベンゼン環になるから都合7個というわけである。では、この形で一辺をベンゼン3個でつくったらどうだろう。
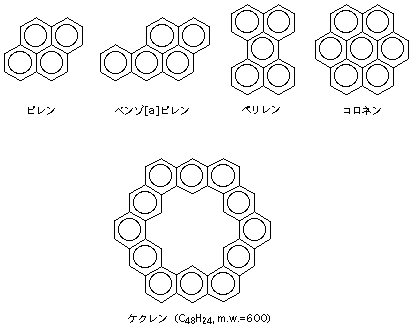
一辺がベンゼン3個、全部で12個のベンゼン環でできる大きな六角形がケクレン(→おもしろ化合物第13話)である。この名前はベンゼンの構造を解明したドイツの化学者ケクレにちなんでいる。まさにベンゼン・オブ・ベンゼン(ベンゼンでつくったベンゼン)というのふさわしい構造をしている。このケクレンが合成されたのは1978年のことである。ケクレンは対称性がよく、きわめて安定な構造であるため、融点は620℃以上と有機化合物にしては異常に高く、またほとんどの溶媒に溶けない。この溶解性の低さのためにその性質を調べるのは大変な苦労だった。ちなみに、ケクレンの分子量はちょうど600である。ベンゼン環を六角形につなぎあわせた一連の化合物の分子量はすべて300の倍数になるという面白い性質がある。コロネンは分子量300だ。
<ねじれ分子のできあがり>
さて、もう一度面状から線状の方にもどろう。線状にベンゼン環をつないでいくには直線のアセン系とジグザグのフェン系があるが、ではどんどん曲がっていくようにつないでいったらどうだろう。フェナントレンに1個ベンゼンをそういうふうに足したのがベンゾ[c]フェナントレンだ。次にもう1個増やすとジベンゾフェナントレンになるが、この分子は平面につくることができない。内側の水素同士がぶつかってしまうのだ。したがって実際の分子の形は水素が互い違いにねじれて配置した形をしている。さらにベンゼン6個になるともはや完全に両端の炭素がねじれて配置した分子になる。

このようにベンゼン環を曲線的につなげていって全体がらせん状にねじれた分子をヘリセン(helix:らせん、→おもしろ化合物第1話)といい、ベンゼン環の数をカッコに表して、[6]ヘリセンのようにいう。この仲間にはどんどんつなげていって[13]ヘリセンなんていうのも知られている。こうなると端のほうはベンゼン環が三層に重なったらせんになっている。さて、らせんといえば当然右巻きと左巻きがある。実はこのヘリセンにも右巻き分子と左巻き分子があるのである。つまり鏡像異性体である。有機化合物における鏡像異性体は、ほとんどが不斉炭素原子つまり4個の異なる置換基がついている炭素によるものであるが、ヘリセンは鏡像異性が分子自体のねじれに由来する興味深い化合物である。
<串だんごからアホウドリまで>
次にベンゼン環を結合を介してつなげた形に移ろう。2個のベンゼンが結合を介してつながった分子はビフェニルである。環境汚染物質として悪名高く、また最近では内分泌攪乱物質でもあるポリ塩化ビフェニル(PCB)はその塩素化体に相当する。ところで、このビフェニル分子自体は、中央の結合の回転によってベンゼン環がくるくる回ることができる。もちろん二つのベンゼン環の共役を考えると共平面構造が安定と考えられるが、とにかく物理的には回転可能である。ところが、ビフェニル結合のオルト位(となりの炭素)に置換基をいれるとその置換基同士がぶつかりあって物理的に平面を保つことが不可能になる。もちろん自由回転もできなくなる。ホルモン活性があって内分泌攪乱物質となりうる物質はPCBの中でもコプラナーPCBとよばれる一群の異性体である。コプラナーは共平面の意味であり、つまり平面性を妨害する置換基をもたないものという意味なのである。

この回転障害に関してビフェニルには面白い性質がある。両方のオルト位に置換基が入った6,6'-ジニトロジフェン酸は鏡像異性体をもつのである。この化合物はオルト位にすべて置換基があるので、それがぶつかりあうためにもちろんベンゼン環は共平面をとることができず、直交している。その直交の仕方が+90度ねじれと-90度ねじれの2通りあり、それが鏡像の関係にあるためである。中央の結合が自由に回転できれば両鏡像体は相互変換可能になるが、この場合途中の共平面状態を通り抜けることができないため、両鏡像体が分離可能になっている。これはヘリセンと同じく不斉炭素をもたない鏡像異性体の例である。ちなみにナフタレン同士を結合したビナフチルではオルト位にひとつずつ置換基をいれただけで安定な鏡像異性体が得られる。そのひとつビナフトールは、キラルな配位子として不斉触媒反応のリガンドに広く用いられている。

さて、3個ベンゼンがつながるとちょうど串だんごのようなテルフェニルができる。ベンゼン同様芳香族性をもつ含硫化合物であるチオフェンを同じように3個つないだテルチエニルは、マリーゴールドに含まれる成分で殺線虫活性化合物として知られている。ベンゼン環がたくさんつながるとその立体的な大きさで分子はひずんでくる。たとえばベンゼンの水素をすべてベンゼン環で置換したヘキサフェニルベンゼンでは、まわりの6個のベンゼン環は平面配置できずに中央のベンゼン環とほぼ直交した配座をとると思われる。いうなれば6枚羽根のプロペラである。これはナフタレンのすべての水素を同様に置換したオクタフェニルナフタレンも同じである。最近、このオクタフェニルナフタレンを2個つないだ形のアルバトロセン(albatross:アホウドリ)という大きな分子が合成された(→おもしろ化合物第11話)。その構造はまさに大きな翼を広げた雄大なアホウドリの名にふさわしい。
また、エタンの全置換体であるヘキサフェニルエタン構造と考えられていた分子は、溶液中ではかなりの部分がトリフェニルメチルラジカルとして存在していることが1897年にすで知られている。分子内に不対電子をもつラジカルは化学的に非常に活性で、安定には存在し得ないものと考えられていたが、このトリフェニルメチルラジカルは安定に溶液中に存在できることが示された初めてのラジカルでもある。
<六角形以外のベンゼンの仲間>
ベンゼンがなぜ特別安定な構造なのかは難しい議論になるが、簡単にいうと環状にsp2炭素がつながった分子では、すべてのπ電子がひとつながりの環状になって安定化されるということである。偶数員環では二重結合をひとつおきに書いていくことができ、つまりすべての炭素が隣の炭素とπ結合をつくれるので都合が良い。では、六角形ではなく四角形や八角形でもよさそうに思える。ところがこれは二つの点でうまくないのである。ひとつは立体的なひずみで、sp2炭素の結合角は120度なので、ちょうど六角形は理想的な配置になるが、四角形や八角形では平面に配置すると結合がひずんでしまうので不安定である。さらに大きな理由は、環状に共役しているπ電子数が4n+2のとき、すなわち4でわりきれない数のときのみ全体の構造が安定になるという規則(ヒュッケル則)があるのである。この規則で表される安定な性質を「芳香族性」という。すなわち安定なのはπ電子数が2,6,10,14,18...で、4,8,12,16...はそれに該当しない。実際、シクロブタジエンやシクロオクタテトラエンはとても不安定な分子である。電子数2では環にならないのではと思われるかもしれないが、中性分子に限らなければ、シクロプロペニルカチオンはπ電子2個の安定環状イオンの例になる。同様に五角形に1電子増えたシクロペンタジエニルアニオンや七角形から1電子減ったシクロヘプタトリエニルカチオンは、いずれも6電子系となり安定である。
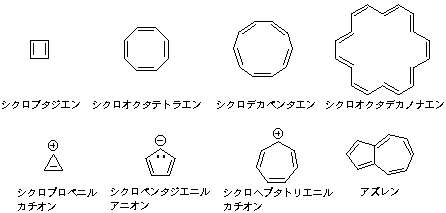
10電子系ではシクロデカペンタエンは安定になる資格があるが、立体的な制約で平面をとれないので実際にはあまり安定ではない。ベンゼンが2個縮環したナフタレンの外周を数えるとちょうど炭素10個になり、これは10電子系安定環といってよい。3個つながった分子、アントラセンとフェナントレンは外周14電子でこれも安定であることがわかる。18電子系くらいに大きくなるとひとつながりの大きな環でもすべての炭素間が120度をとった平面になれるので、シクロオクタデカノナエンは安定な芳香族分子として存在できることが知られている。
ナフタレンの異性体でアズレンという炭化水素がある。アズレンでは五角形と七角形が縮環しているが、やはり10π系であり、ベンゼン環を含まない芳香族化合物の代表である。ナフタレンは無色だが、アズレンは美しい藍色(azure:藍)をしている。
<炭素のないベンゼン!?>
安定な芳香族性をもつ環はなにも炭素だけのものではない。ベンゼンの炭素を1個窒素で置換したピリジンはやはり6電子系の安定な分子であるし、核酸塩基にあるピリミジン環はさらに窒素が1個増えているがこれも安定だ。どんどん窒素で置換していくと全部窒素になったN6分子(ヘキサアザベンゼン)になるが、これも低温で合成されたという報告がある。ただしいうまでもなくこれは有機化合物ではない。無機化合物といえば、ホウ素と窒素を互い違いに配したボラジンはベンゼンと等電子構造で、ホウ素の電子不足性と窒素の電子過剰性が補いあうのでベンゼンによく似た大変安定な分子(無機ベンゼン)である。
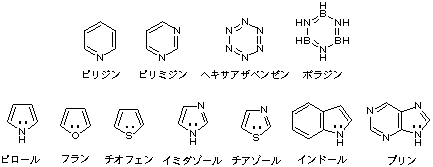
窒素や酸素は非共有電子対をもち、その電子をπ電子系に参加させることができるので、たとえば五角形でも6電子系安定構造をつくることができる。ピロール、フラン、チオフェンがこの例である。さらにヘテロ原子の増えたイミダゾール(ヒスチジンの構成分)やチアゾール(チアミンの構成分)なども6電子系である。またトリプトファンのインドールや核酸塩基のプリンは10電子系になり安定であることがわかる。








