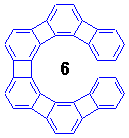
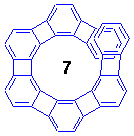
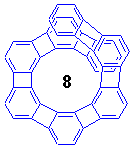
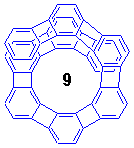




このらせん形ヘリフェン分子、合成してみると色々と予想外の事実が明らかになりました。
まず個々のベンゼン環の性質ですが、末端のベンゼン環は芳香族性をもち、それに対してはじから2番目のベンゼン環はシクロヘキサトリエン形になっていることがNMRの結果からわかりました。このように、らせん状に連なるベンゼン環は交互に非局在(芳香族)形と局在(トリエン)形の性質をもっています。
これは、スペーサー部分の四員環がシクロブタジエン構造になると反芳香族性で不安定となるため、ビスメチレンシクロブテン環構造になるほうが有利ためです。ちょうど、アセン系の縮合ベンゼンがナフタセン、ペンタセンと伸びるにつれて不安定なビスメチレンシクロヘキサジエン構造をとらざるをえないために安定性が低下する、というのの裏返しなわけです。
次に、らせんの異性化反応です。ヘリセンはしっかりした構造なので、n=6でも室温で安定なキラル結晶が得られましたが、ヘリフェンはフレキシビリティが高く、計算で求められた異性化エネルギー障壁は、n=6で3.6 kcal/mol、n=7で17.0 kcal/molしかありません(ちなみにヘリセンはそれぞれ、36.2、41.7 kcal/mol)。
実際に、イソプロピル基やメトキシメチル基を1個導入して対称性を打破した分子を合成し、置換基のメチル基あるいはメチレン水素の非等価性の温度依存性(らせんの向きが固定されると非等価になる)を低温NMRで観測してみると、n=6では-70℃でもシグナルが分離せず、n=7では-27℃で分離しました(これから計算した異性化障壁は12.6 kcal/mol)。
なお驚いたことに、異性化を困難にするためにn=7で両端のベンゼン環にメチル基を2個ずつ置換させた分子をつくったところ、逆に-70℃でもピークが分離しなくなってしまいました。これは、分子のねじれぐあいが高まって基底状態のエネルギーが上昇し、かえって遷移状態とのエネルギー差が小さくなったためと説明されています。
[6]helipheneの合成法は以下のようです。
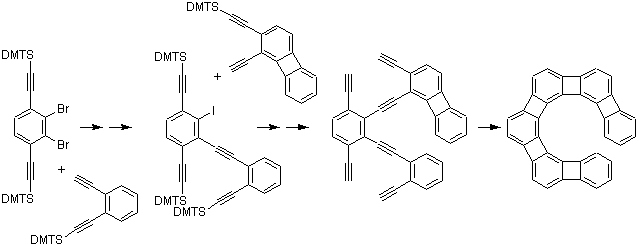
合成戦略はシンプルで、ハロベンゼンとアルキンをパラジウム触媒でカップリングさせてジフェニルアセチレンとして、ちょうど分子内で六角形を構成する位置に配置した3個のアセチレンをコバルト触媒存在下光反応で一気に環化してベンゼン環を構築するという手法です。この方法でn=6〜9のヘリフェンが合成されました。n=7〜9の場合だと、最後の光環化で一度に3個のベンゼン環をつくっています(環化反応の収率は2%)。なお、DMTSはdimethylthexylsilyl基(SiMe2(CMe2CHMe2))です。
さて、ではn=8や9になると異性化障壁は大きくなって光学分割が可能になったでしょうか。答は残念ながらNOなのです。[8]helipheneの異性化エネルギーは13.4 kcal/molでn=7よりも1 kcal/mol上昇したに過ぎません。[9]helipheneにいたっては、溶解度の限界である-45℃にしてもモノメトキシメチル体のシグナルがNMRで分離できず、エネルギー障壁は12 kcal/mol以下ということです。このように、一見するとらせんの重なり具合が大きくなってもそれが異性化エネルギーの上昇に直接結びつかないというのはとてもおもしろいですね。
最後に、らせん状ではなく両端をつないでしまった大環状angular phenyleneに触れておきましょう。
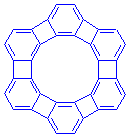
前にでてきたベンゼン・オブ・ベンゼン、ケクレンにちょっと似ています。ねじれもないし平面で安定そうな分子に見えます。実はこの分子、その名もアンチケクレン(antikekulene)は私の知る限りまだ合成されていません。電子が非局在化すると不安定になる反芳香族のシクロブタジエン環が平面構造では不利になることと、分子全体の外周が24π系、内周が12π系といずれも反芳香族になるために大環状アヌレン形もとれないためと思われます(ちなみにケクレンは外周30π、内周18πのいずれも芳香族)。
ref. S.Han, A.D.Bond, R.L.Disch, D.Holmes, J.M.Schulman, S.J.Teat, K.P.C.Vollhardt and G.D.Whitener Angew. Chem. Int. Ed., 2002, 41, 3223, S.Han, D.R.Anderson, A.D.Bond, H.V.Chu, R.L.Disch, D.Holmes, J.M.Schulman, S.J.Teat, K.P.C.Vollhardt and G.D.Whitener Angew. Chem. Int. Ed., 2002, 41, 3227.
蛇足ながら、corresponding authorのK.P.C.Vollhardtは、あのボルハルト・ショアー有機化学の著者です。